Test de Western blot: Électrophorèse de protéines sur gel
Updated by J.P.Qu'est-ce que le western blotting ?
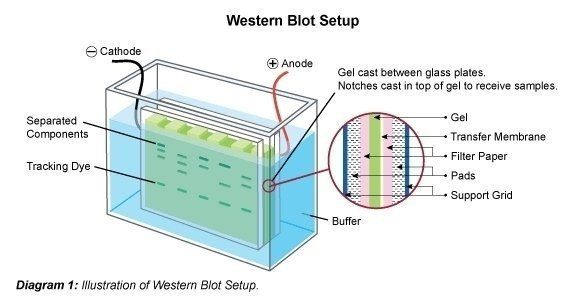
Le Western Blot (aussi appelé immunotransfert) est une technique employée pour analyser des protéines individuelles dans un mélange protéique (par ex., un lysat de cellules). Dans le cadre du Western blot (immunotransfert), le mélange protéique est soumis à une électrophorèse sur gel dans une matrice porteuse (SDS-PAGE, PAGE native, focalisation isoélectrique, électrophorèse sur gel bidimensionnelle, etc.) afin de trier les protéines par taille, charge, ou toute autre différence au sein des bandes individuelles de protéines. Les bandes de protéines séparées sont ensuite transférées vers une membrane porteuse (par ex., nitrocellulose, nylon ou PVDF). Ce procédé porte le nom de transfert. Les protéines adhèrent à la membrane de la même manière qu'elles ont été séparées en raison des interactions entre les charges. Les protéines de cet immunotransfert peuvent ensuite être utilisées pour être liées à l'anticorps en vue de la détermination.
On utilise des anticorps pour détecter des protéines cibles sur le Western blot (immunotransfert). Les anticorps sont conjugués à des marqueurs fluorescents ou radioactifs ou encore à des enzymes pour provoquer une réaction suite à l'ajout d'un réactif, entraînant une coloration ou une émission de lumière qui favorise la détection.
Le terme
s'appuie sur un jeu de mots. Le transfert de Southern, qui est une méthode de détection de séquences ADN spécifiques, tire son nom de Ed Southern, qui a été le premier à décrire cette procédure. Le Western blot (immunotransfert), de même que le transfert de Northern (pour la détection d'ARN), joue sur la signification de ce nom.Quel type d'électrophorèse de protéines sur gel peut-on réaliser?
Différents types d'électrophorèse de protéines sur gel peuvent être employés, en fonction des critères de séparation des protéines. Les méthodes d'électrophorèse communément utilisées sont:
, native-PAGE et la focalisation isoélectrique.SDS-PAGE
Il s'agit d'une méthode de dénaturation en ce qu'elle menace les protéines avec un détergent SDS (dodécylsufate de sodium) anionique. Les structures secondaire et tertiaires sont alors détruites. De plus, le SDS se lie aux protéines et couvre leurs charges chimiques, entraînant l'obtention de protéines à charge négative égales. Par conséquent, la séparation suivante intervient uniquement en fonction de la taille des chaînes polypeptidiques dans le gel de polyacrylamide.
Native PAGE
Des protéines natives, dépliées et non dénaturées peuvent être séparées grâce à cette méthode. Cette dernière permet de séparer les protéines qui ne peuvent être atteintes par d'autres méthodes. La séparation des protéines modifiées et non modifiées de même type (par ex., protéine phosphorylée/non phosphorylée) en est un exemple. La PAGE native peut également être utilisée pour confirmer des conformations pertinentes sur le plan biologique, telles que les formes di-, tri- ou tétramériques des protéines (contrairement à la SDS-PAGE, qui séparerait les chaînes peptidiques individuelles et dénaturées). Cette méthode peut aussi permettre de détecter divers complexes de protéines différentes.
La séparation au moyen de la méthode PAGE native dépend d'un certain nombre de paramètres comme la charge, la taille et la structure tridimensionnelle de la protéine. Un tampon adapté est requis pour préserver le repli tridimensionnel de la protéine. L'applicabilité du tampon dépend du point isoélectrique et des charges de la protéine.
Focalisation isoélectrique
Cette méthode s'appuie sur le fait qu'une protéine possède une certaine charge à des valeurs de pH données. Selon le pH, les groupes fonctionnels basiques ou acides contribuent à augmenter ou à diminuer la charge totale de la protéine. Le point isoélectrique est défini comme le point auquel la charge de la molécule est nulle du fait que la quantité de charges positives et de charges négatives dans la molécule est identique.
Des gels en gradient spéciaux sont nécessaires pour la focalisation isoélectrique du fait que le pH varie d'acide à basique d'un gradient à un autre dans le gel. En raison de la charge électrique associée au gel, la protéine se déplace jusqu'au point dans le gel où la charge du gel est identique à celle de la protéine et où la charge totale est nulle : c'est ce que l'on appelle le point isoélectrique. Cette méthode est donc utilisée pour séparer les protéines en fonction de leur charge, ainsi que pour déterminer le point isoélectrique d'une protéine cible. La séparation intervient en fonction de la charge de la protéine ou du nombre de groupes acides et basiques contenus dans la protéine.
Les méthodes d'électrophorèse de protéines sur gel décrites plus haut peuvent également être combinées pour séparer les protéines. Le choix de la méthode dépend des exigences spécifiques de l'expérience
Blotting
Une fois le mélange de protéines séparé, les bandes de polypeptides sont transférées vers une membrane porteuse. Pour ce faire, la membrane est fixée au gel et ce « sandwich » est transféré vers une chambre d'électrophorèse. Il est possible qu'une partie du SDS soit lavée, et que la protéine soit en partie renaturée, c'est-à-dire qu'elle regagne sa structure bidimensionnelle et tridimensionnelle. Cependant, la charge électrique appliquée entraîne la migration verticale des protéines en dehors du gel, dans le même sens que celui emprunté lors de leur migration dans le gel, pour finir sur la membrane. Les bandes de protéines sont alors liées à la membrane. Les bandes « transférées » peuvent désormais être utilisées à d'autres fins (par ex., pour la détection de protéines spécifiques avec des anticorps spécifiques).
Immunodétection
Il est possible d'identifier des anticorps spécifiques une fois les protéines séparées et transférées. Les anticorps (monoclonaux ou polyclonaux) spécifiques se lient à « leur » bande de protéines. Les anticorps sans liaison spécifique sont éliminés par lavage à l'aide de tampons contenant un détergent. De plus, des poches de liaisons non spécifiques peuvent se retrouvées bloquées avant que des anticorps spécifiques ne soient ajoutés.
Les anticorps primaires sont généralement appliqués en premier, avant d'être reconnus par un anticorps secondaire. L'anticorps secondaire est conjugué à de la couleur, de la radioactivité ou une enzyme aux fins de la détection. Des anticorps conjugués à de la biotine sont également utilisés à cette fin.
Il peut parfois être utile d'utiliser des anticorps primaires polyclonaux car ces anticorps reconnaissent divers épitopes, contrairement aux anticorps monoclonaux dont l'affinité de liaison est limitée. Suite à l'immunodétection, il est possible d'éliminer l'anticorps de la membrane pour une analyse approfondie avec d'autres anticorps (par ex., pour détecter d'autres anticorps spécifiques dans le mélange protéique soumis à analyse).
L'analyse du Western blot est ensuite réalisée à l'aide d'un éventail de systèmes d'imagerie différents (par ex., luminescence, réaction colorante, autoradiographique).
Note: L'identification d'une protéine d'intérêt dans un Western blot repose entre autres facteurs sur son poids moléculaire. Pour ce faire, les protéines séparées par électrophorèse de l'échantillon sont comparées à un étalon de masse moléculaire d'une composition connue.
Pourquoi réaliser un Western blot (immunotransfert) ?
La méthode du Western blot (immunotransfert) offre toute une gamme d'avantages par comparaison à d'autres dosages d'immuno-absorption tels que le dosage ELISA.
Le Western blot (immunotransfert) dépasse le concept du test ELISA en permettant la séparation du mélange protéique par taille, charge et/ou conformation. La méthode d'élimination décrite permet de détecter plusieurs cibles, contrairement au test ELISA qui permet de ne détecter qu'une seule protéine. Étant donné que l'électrophorèse de protéines sur gel sépare les protéines en bandes, il est possible de déterminer la taille de la protéine/du polypeptide cible. Il est également possible de (semi-)quantifier la protéine d'intérêt en exécutant en parallèle une analyse interne de quantité sur les échantillons dans le gel. De la même manière, la teneur en protéines des échantillons peut être comparée (« échantillon A comporte plus de protéines que l'échantillon B »).
Note: Naviguez parmi plus
Un des inconvénients du Western blot (immunotransfert) réside dans le fait qu'il est coûteux en temps (par rapport au test ELISA) et exige de l'expérimentateur une solide expérience. En outre, il requiert une optimisation des conditions expérimentales (par ex., isolation des protéines, tampons, type de séparation, concentration de gel, etc.).
Il existe de nombreux types différents et de nombreuses méthodes différentes de Western blot (immunotransfert). C'est pourquoi il couvre de nombreux sujets et de nombreuses applications.
Anticorps populaires pour le Westernblotting
Ressources
Contrôles d'isotype pour le Western Blotting
Anticorps, kits et outils TrueBlot®
Qu'est-ce que le Western Blotting ?
Le Western blotting est une méthode de laboratoire permettant de détecter et de caractériser les protéines d'un échantillon. Le Western blotting, également connu sous le nom d'immunoblotting, est une technique de laboratoire largement utilisée en biologie moléculaire et en biochimie. Elle permet de détecter des protéines spécifiques dans un mélange complexe de protéines extraites de cellules ou de tissus. La technique comprend une série d'étapes qui commencent par la séparation des protéines en fonction de leur taille à l'aide d'un gel d'électrophorèse. Les protéines sont ensuite transférées sur une membrane, puis sondées avec des anticorps spécifiques qui se lient à la protéine cible d'intérêt. Grâce à une série de réactions chimiques, les anticorps liés sont visualisés, ce qui permet d'identifier et de quantifier la protéine. Le Western Blotting fournit des informations précieuses sur l'expression des protéines, les modifications post-traductionnelles et les interactions protéine-protéine, ce qui en fait un outil indispensable pour la recherche biologique et le diagnostic clinique.
À quoi sert le Western Blotting ?
Le Western Blotting est utilisé pour identifier les protéines d'intérêt dans un mélange complexe de protéines. Elle est couramment utilisée en biologie moléculaire pour déterminer l'expression des protéines et détecter les protéines cibles dans les échantillons biologiques.
Comment fonctionne la méthode du Western blot ?
Dans un Western blot, les protéines sont d'abord séparées en fonction de leur taille par électrophorèse sur gel, puis transférées sur une membrane de nitrocellulose ou de PVDF. La membrane est ensuite incubée avec un anticorps primaire qui se lie spécifiquement à la protéine cible. Après avoir éliminé par lavage tout anticorps primaire non lié, la membrane est incubée avec un anticorps secondaire qui reconnaît et se lie à l'anticorps primaire. L'anticorps secondaire est généralement conjugué à une molécule de détection, telle qu'une enzyme ou une étiquette fluorescente, qui génère un signal pouvant être visualisé.
Quelle est la différence entre un Western blot réducteur et un Western blot natif ?
Dans un Western blot réducteur ou dénaturant, les protéines sont analysées après avoir été dénaturées et réduites pour rompre leurs liaisons disulfures. Il en résulte un échantillon de protéines qui n'est plus dans son état natif, mais qui permet la détection de sous-unités ou de monomères individuels. En général, le tampon d'électrophorèse contient du SDS pour enrober uniformément les protéines dénaturées et les maintenir linéarisées afin qu'elles soient séparées en fonction de leur poids moléculaire. Un Western blot natif est utilisé pour analyser les protéines dans leur état natif sans perturber leur structure ou leurs interactions. Il est généralement réalisé dans des conditions non réductrices, ce qui signifie que les liaisons disulfures entre les résidus de cystéine ne sont pas réduites. Leur structure et éventuellement leurs interactions avec d'autres protéines restent intactes et influencent la migration lors de l'électrophorèse. Les Western blots réductrices sont couramment utilisées pour détecter une protéine particulière ou une sous-unité d'un complexe protéique. Les Western blots natifs sont utilisés pour analyser des protéines intactes ou des interactions protéine-protéine.
Quels sont les matériaux et les réactifs nécessaires à la réalisation d'un Western blot ?
Pour réaliser un Western blot, il faut un échantillon de protéine, un gel de polyacrylamide, une membrane de transfert en nitrocellulose ou PVDF, un tampon de transfert et de blocage, un anticorps primaire et un anticorps secondaire, des réactifs de détection tels que le substrat ECL, ainsi que l'équipement nécessaire à l'électrophorèse du gel et au transfert de la membrane. Des réactifs supplémentaires tels que des agents réducteurs, des tampons de chargement et des marqueurs de poids moléculaire peuvent également être nécessaires en fonction de l'expérience spécifique.
Comment prépare-t-on les échantillons pour le Western Blot ?
Pour un Western Blot réducteur, les échantillons sont dissous dans un tampon de Laemmli, puis bouillis pour s'assurer que toutes les protéines de l'échantillon sont dénaturées. Le mélange est ensuite rapidement refroidi sur de la glace avant d'être chargé afin de conserver les protéines sous leur forme dénaturée et linéaire. Pour préparer les échantillons en vue d'un Western blot natif, l'échantillon est généralement mélangé à un tampon d'échantillon natif contenant un détergent non ionique, tel que le Triton X-100, afin de solubiliser les protéines sans perturber leur structure ou leurs interactions natives. Le bleu de Coomassie peut être utilisé dans le Western blotting natif pour lier et enrober les protéines pendant l'électrophorèse (PAGE natif bleu).
Quel type de gel faut-il utiliser pour le Western blot ?
Le gel de polyacrylamide est le gel le plus couramment utilisé pour le Western blotting. Le SDS-PAGE dénaturant est généralement utilisé pour séparer les protéines en fonction de leur poids moléculaire. Le SDS-PAGE implique l'utilisation d'un système de tampon discontinu avec deux gels - un gel d'empilement et un gel de résolution. Le gel d'empilage a un faible pourcentage d'acrylamide et sert à concentrer l'échantillon de protéines dans une bande étroite, tandis que le gel de résolution a un pourcentage plus élevé d'acrylamide et sépare les protéines en fonction de leur taille. Pour le Western blotting réducteur, un agent réducteur tel que le bêta-mercaptoéthanol ou le dithiothréitol (DTT) est souvent ajouté au tampon de l'échantillon pour rompre les liaisons disulfures entre les résidus de cystéine et dénaturer complètement les protéines. Pour le Western blotting natif, le gel est préparé dans des conditions non dénaturantes et les liaisons disulfures ne sont pas réduites. On utilise généralement un système de gel "natif" ou un système de gel "bleu-natif" (BN-PAGE), qui utilise un détergent non ionique tel que le Triton X-100 pour maintenir la conformation native des protéines.
Comment les protéines sont-elles transférées sur la membrane ?
Les protéines sont le plus souvent transférées du gel de polyacrylamide à une membrane de transfert par électro-buvardage. Dans un transfert par cuve (transfert humide), le gel est pris en sandwich entre deux tampons ou éponges imbibés de tampon de transfert, et une membrane telle que la nitrocellulose ou le PVDF est placée sur le gel. La pile est ensuite placée dans une chambre d'électrophorèse et un courant est appliqué pour transférer les protéines du gel sur la membrane. Le tampon de transfert contient généralement un système tampon qui maintient un pH et une force ionique favorables au transfert des protéines, ainsi que du méthanol ou de l'éthanol pour améliorer l'efficacité du transfert. Dans le cas d'un "transfert semi sec", des tampons de papier filtre imbibés de tampon de transfert entourent le gel et la membrane. Le sandwich est placé en contact direct avec deux électrodes par lesquelles un champ électrique est appliqué. Après le transfert, la membrane est bloquée pour empêcher la liaison non spécifique des anticorps de détection, puis incubée avec des anticorps primaires et secondaires spécifiques de la protéine d'intérêt. Les anticorps liés sont ensuite détectés par chimiluminescence ou par d'autres méthodes de détection, et le signal est capturé à l'aide d'un film à rayons X ou d'un système d'imagerie numérique.
Comment réduire la liaison non spécifique dans le Western blot ? Comment se produit le blocage de la membrane et pourquoi est-il important ?
Après le transfert des protéines du gel d'électrophorèse sur la membrane de blotting, cette dernière est incubée avec un tampon de blotting contenant des protéines telles que la BSA ou le lait en poudre. Ces protéines recouvrent la membrane de manière homogène afin de bloquer la liaison non spécifique des anticorps de détection. Le blocage de la membrane empêche la liaison non spécifique et réduit les signaux de fond.
Quels sont les anticorps utilisés pour le Western blotting ?
Un anticorps primaire spécifique de la protéine d'intérêt ou un marqueur de protéine est utilisé pour se lier à la protéine. Un anticorps secondaire qui se lie à l'anticorps primaire est généralement utilisé pour la détection. Souvent, l'anticorps secondaire est conjugué à une enzyme comme la peroxydase de raifort (HRP) qui transforme un substrat tel que l'ECL pour la détection de la bande de protéine marquée par l'anticorps sur la membrane de blotting. Les anticorps primaires reconnaissent des protéines spécifiques, tandis que les anticorps secondaires se lient aux anticorps primaires et produisent un signal détectable. Un anticorps secondaire marqué peut être utilisé avec des anticorps primaires dirigés contre différentes protéines d'intérêt et peut être utilisé pour amplifier le signal. Il est également possible de marquer directement l'anticorps primaire afin d'éviter une seconde incubation et les étapes de lavage associées.
Comment les bandes de protéines sont-elles détectées sur la membrane ?
Les bandes de protéines sont visualisées à l'aide de réactifs de détection, tels que des substrats chimiluminescents transformés par une enzyme comme la HRP. Le signal chimiluminescent produit peut ensuite être capturé à l'aide d'un film ou d'un système d'imagerie numérique.
Comment la quantité de protéines est-elle quantifiée dans le Western blot ?
La quantification des protéines par Western blot est semi-quantitative. En raison de ses limites de détection supérieure et inférieure, le Western blot est avant tout une méthode qualitative. La quantité de protéines peut être estimée par Western blot en mesurant l'intensité du signal protéique sur la membrane à l'aide de la densitométrie. Cela implique l'utilisation d'un instrument spécialisé tel qu'un scanner ou un système d'imagerie pour capturer l'intensité du signal des bandes de protéines sur la membrane, généralement sous la forme d'une image numérique. L'image peut ensuite être analysée à l'aide d'un logiciel qui mesure l'intensité du signal de chaque bande, et cette valeur peut être comparée à une courbe standard ou à un échantillon de contrôle pour quantifier la quantité de protéines. Par ailleurs, certains systèmes de Western blotting utilisent une échelle de poids moléculaire pré-colorée ou une protéine de référence dans l'échantillon comme contrôle interne pour estimer la quantité de protéine sur la base de son intensité relative par rapport au contrôle.
Comment la liaison spécifique peut-elle être détectée dans le Western blot ? Comment la qualité et la reproductibilité des données du Western blot sont-elles assurées ?
La liaison spécifique peut être confirmée en comparant des contrôles positifs et négatifs, différents anticorps primaires contre la même protéine d'intérêt et des méthodes orthogonales telles que la chromatographie, la spectrométrie de masse ou la cytométrie de flux. Les résultats reproductibles à travers les réplicats biologiques et techniques garantissent la qualité des données.
Quels sont les avantages de la technique du Western blot par rapport à d'autres méthodes d'analyse des protéines ?
Le Western blot permet une identification hautement spécifique des protéines, une analyse semi-quantitative, la possibilité d'examiner plusieurs protéines dans un seul échantillon et, selon le schéma expérimental, la détection des interactions entre les protéines. Par rapport à d'autres méthodes axées sur les protéines, telles que la chromatographie, la cytométrie de flux ou la spectrométrie de masse, le Western blot est peu coûteux, facilement accessible et rapide.
Quels sont les problèmes et les défis typiques du Western blotting et comment peuvent-ils être résolus ?
Les problèmes typiques de la technique du Western blot comprennent la liaison non spécifique et les signaux de fond, un signal faible et la difficulté de détecter des protéines faiblement exprimées, ainsi que la variabilité d'une expérience à l'autre. Ces problèmes peuvent être résolus en optimisant les anticorps, les méthodes de blocage et les paramètres du protocole, ainsi qu'en utilisant des contrôles internes.
Existe-t-il des méthodes alternatives au western blotting ?
Oui, il existe d'autres méthodes d'analyse des protéines telles que l'ELISA, la spectrométrie de masse, les matrices de protéines, la cytométrie de flux et les techniques immunohistochimiques qui peuvent être utilisées en fonction de l'application.
Quelles sont les principales applications du transfert de Western dans la recherche ou le diagnostic clinique ?
Le transfert de Western est une technique polyvalente qui permet de détecter une protéine particulière dans un échantillon. Elle peut donc être appliquée à un large éventail de recherches et d'applications cliniques, ce qui en fait un outil essentiel pour de nombreux scientifiques et cliniciens. Parmi les principales applications de la technique du Western blot, citons le diagnostic de maladies par la détection de marqueurs spécifiques, la validation d'anticorps pour des applications en aval telles que l'immunohistochimie ou la cytométrie de flux, la détection d'anticorps dans des échantillons de sérum pour évaluer l'efficacité des vaccins, ou encore le contrôle de la qualité dans la production de biosimilaires afin d'en garantir la cohérence.




