Anticorps neutralisant SARS-CoV-2
Les anticorps neutralisants présentent un intérêt particulier pour les scientifiques. Ils stoppent efficacement l'infection en bloquant l'interaction entre le virus SRAS-CoV-2 et les cellules hôtes. La plupart des anticorps neutralisants répondent au domaine de liaison au récepteur (RBD) de la protéine spike, qui se lie directement au récepteur de surface cellulaire ACE2. antibodies-online.com propose deux nAbs basés sur le clone CR3022 ainsi que deux nAbs basés sur le clone MM43.
Voir tous les anticorps neutralisants du SRAS-CoV-2
L'une des questions qui se posent concernant les nouvelles variantes émergentes du SRAS-CoV-2 est de savoir si les tests et les produits pharmaceutiques existants basés sur les anticorps restent utilisables. En collaboration avec Nanotemper, nous avons mesuré l'affinité de notre anticorps RBD de la protéine S CR3022 (ABIN6952546) pour la protéine S trimérique canonique du SRAS-CoV-2 et celles des variantes concernées B.1.1.7 / alpha, B.1.351 / bêta, B.1.617.2 / delta, B.1.617.1 / kappa et P.1 / gamma par thermophorèse à micro-échelle (MST). Dans une deuxième itération, nous avons reconnu le variant dominant B.1.1.529 / omicron et étendu la sélection d'anticorps avec neutralizing antibodies MM43 (ABIN7036075) and MM117 (ABIN7042145). Découvrez les résultats ci-dessous, soit résumés dans le tableau, soit sous forme détaillée avec les courbes de liaison MST jointes. Notre webinaire fournit plus d'informations sur les expériences et leur impact sur les tests et la production de vaccins. Nous visons à garder les mesures de comparaison à jour en ce qui concerne les nouveaux anticorps et les variantes émergentes.
MST l'analyse des nAbs du SRAS-CoV-2
Webinar: "Effect of SARS-CoV-2 Variants for Assays and Vaccines"
Anticorps neutralisants du SRAS-CoV-2 et préférences de liaison correspondantes
| Canonical | Delta B.1.617.2 | Omicron B.1.1.529 | |
|---|---|---|---|
| CR3022 ABIN6952546 |
++ | + | + |
| MM43 |
+++ | ++ | - |
| MM117 |
+ | + | ++ |
Thermophorèse à micro-échelle pour l'analyse des nAbs du SRAS-CoV-2
CR3022
Le clone de clone de l'anticorps CR3022 (ABIN6952546), qui est à la base des deux anticorps, a été isolé à l'origine chez un patient convalescent atteint du SRAS à Singapour 1. Il a été démontré que ce clone était efficace dans les essais de neutralisation de différentes souches de CoV-SRAS en synergie avec d'autres anticorps ciblant les RBD. Son épitope ne chevauche pas le site de liaison de l'enzyme de conversion de l'angiotensine 2 (ACE2), ce qui le rend accessible à d'autres anticorps neutralisants. Depuis l'apparition de COVID-19, il a été démontré que CR3022 se lie à la protéine S RBD du SRAS-CoV-2 de manière similaire 2. Les essais de cristallisation de CR3022 lié à sa cible SRAS-CoV-2 ont fourni des informations importantes sur les points d'attaque possibles pour les traitements contre ce virus.3. En outre, CR3022 a été utilisé comme contrôle positif dans les tests sérologiques pour détecter les anticorps dans le sérum humain qui se lient à la S-protéine du SRAS-CoV-2 4.
Une constante de dissociation plus élevée indique une liaison plus faible, c'est-à-dire que la liaison de CR3022 à la protéine S B.1.351 est nettement plus faible que celle des trois autres variantes. Cependant, une KD de l'ordre du nanomolaire indique une affinité élevée de l'anticorps pour les quatre protéines S testées. En conséquence, l'anticorps neutralisant reste un outil important pour les immunodosages du SRAS-CoV-2.
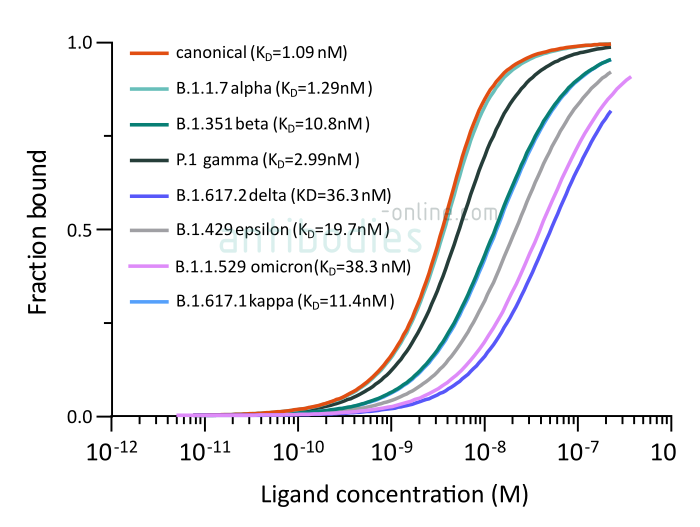
Fig. 1: Microscale thermophoresis measurements of binding of SARS-CoV-2 Spike S1 antibody (RBD) CR3022 (ABIN6952546) to SARS-CoV-2 Spike (Trimer) from wt SARS-CoV-2 (ABIN6952670) or variants B.1.1.7 alpha (ABIN6963742), B.1.351 beta (ABIN6963740), P.1 gamma (ABIN6964443), B.1.6172 delta (ABIN6999328), B.1.429 epsilon (ABIN6972926), B.1.617.1 kappa (ABIN6976302) and B.1.1.529 omicron (ABIN7041433). The determined dissociation constants KD are indicated.
MM117
MM117 (ABIN7042145) est un anticorps monoclonal produit chez la souris qui se lie à la protéine B.1.1.529 omicron S du SRAS-CoV-2 de manière plus étroite que celle des autres variantes..
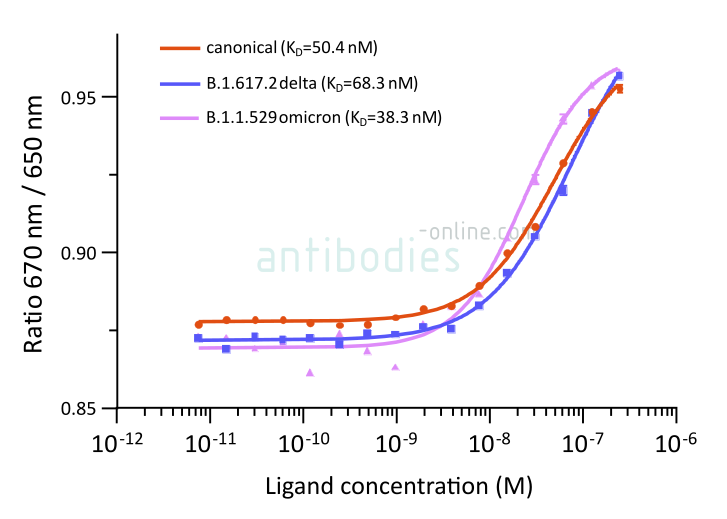
Fig. 2: Microscale thermophoresis measurements of binding of SARS-CoV-2 Spike S1 antibody (RBD) MM117 (ABIN7042145) to SARS-CoV-2 Spike (Trimer) proteins of various lineages, including B.1.617.2 (delta) and B.1.1.529 (omicron). The determined dissociation constants KD are indicated.
MM43
Les anticorps monoclonal murin MM43 (ABIN7036075) se lient en revanche à la protéine S canonique de manière plus étroite que CR3022 et MM117. La liaison à la protéine delta S du SRAS-CoV-2 B.1.617.2 est également très bonne. Cependant, la liaison de cet anticorps à la protéine S du variant omicron est complètement abolie en raison des mutations de la protéine.

Fig. 3: Microscale thermophoresis measurements of binding of SARS-CoV-2 Spike S1 antibody (RBD) MM43 (ABIN7036075) to SARS-CoV-2 Spike (Trimer) of various lineages. Binds SARS-CoV-2 S proteins of various lineages, including B.1.617.2 (delta). Does NOT bind the S protein of SARS-CoV-2 B.1.1.529 (omicron).The determined dissociation constants KD are indicated.
Anticorps neutralisants disponibles pour le SRAS-CoV-2
- (8)
- (15)
- (1)
- (5)
- (3)
Expérience de pensée avant la mesure du DSPM
La protéine S du SRAS-CoV-2 est essentielle au contact des virions avec la cellule hôte via le récepteur ACE2. Les points de contact de l'ACE2 sont situés entre les acides aminés K417 et Y505 du domaine de liaison au récepteur de la protéine S (RBD). Les anticorps neutralisants (nAbs) ciblant le RBD perturbent cette interaction et peuvent donc empêcher l'interaction entre le SRAS et le CoV-2. Sur la base des points de contact connus de l'anticorps neutralisant CR3022 avec la protéine S, nous avions prédit que l'anticorps se lierait toujours à la protéine des variantes préoccupantes. (Fig.4).6,7,8,9
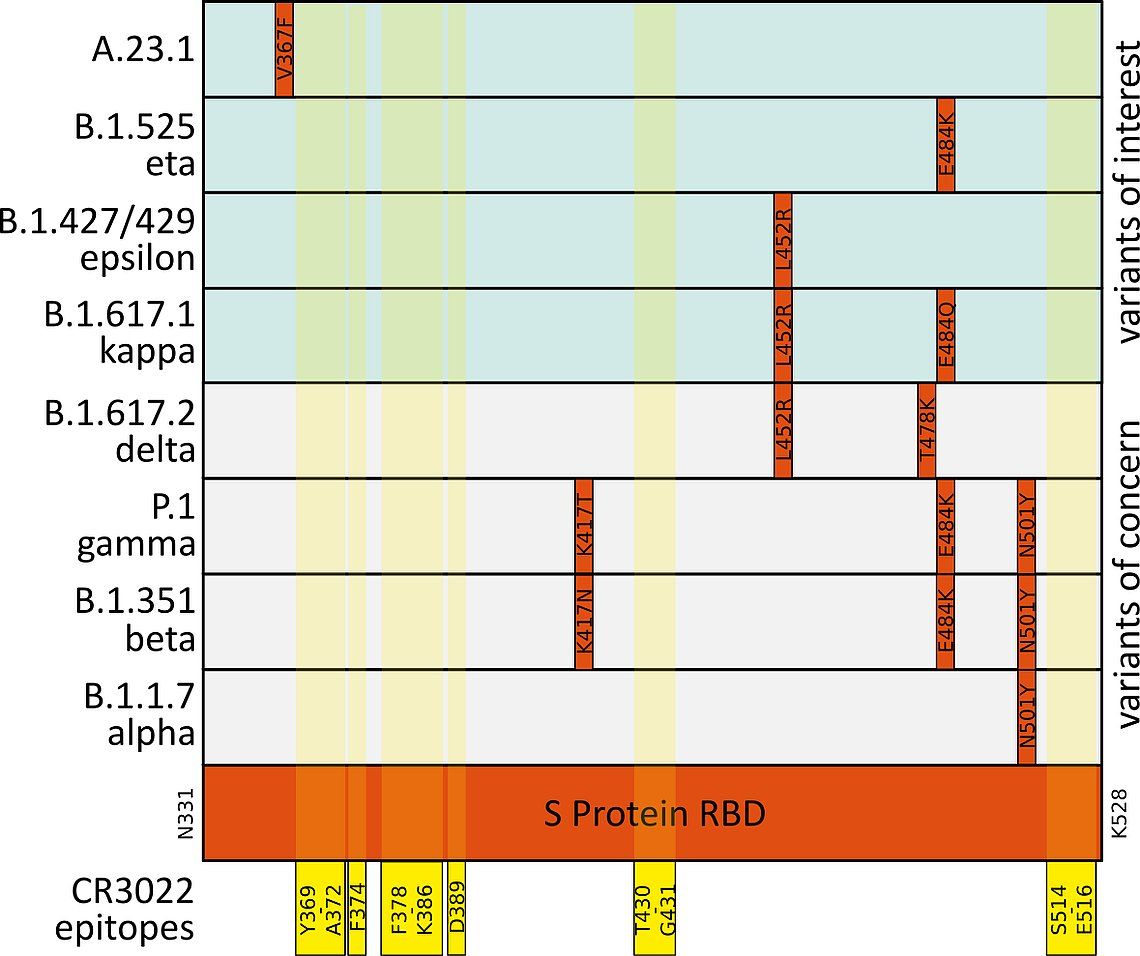
Fig. 4: Mutations (indicated in red) in the SARS-CoV-2 S Protein receptor binding domain (RBD, mint) in variants of concern (light grey) and variants of note (light mint). Epitopes of the neutralizing antibody CR3022 ABIN6952546 are highlighted in yellow.6,7,8,9
Cette prédiction a été confirmée par les mesures de MST. Le variant B.1.1.529 / omicron présente, en comparaison, le plus de mutations dans le site RBD. Néanmoins, la liaison de CR3022 a pu être confirmée expérimentalement. Des informations de fond plus approfondies peuvent être trouvées dans notre webinaire "Effet de différentes variantes du SRAS-CoV-2 sur les tests et les vaccins COVID-19".
Webinar: "Effect of Different SARS-CoV-2 Variants on COVID-19 Assays and Vaccines"
Références
- (1) ter Meulen, J. et al. Human monoclonal antibody combination against SARS coronavirus: synergy and coverage of escape mutants. PLoS Med. 3, e237–e237 (2006).
- (2) Tian, X. et al. Potent binding of 2019 novel coronavirus spike protein by a SARS coronavirus-specific human monoclonal antibody. Emerg. Microbes Infect. 9, 382–385 (2020).
- (3) Yuan, M. et al. A highly conserved cryptic epitope in the receptor-binding domains of SARS-CoV-2 and SARS-CoV. Science 80. eabb7269 . doi:10.1126/science.abb7269 (2020).
- (4) Stadlbauer, D. et al. SARS-CoV-2 Seroconversion in Humans: A Detailed Protocol for a Serological Assay, Antigen Production, and Test Setup. Curr. Protoc. Microbiol. 57, e100 (2020).
- (5) Thao, T. et al. Rapid reconstruction of SARS-CoV-2 using a synthetic genomics platform Nature. (2020).
- (6) Barnes CO et al. SARS-CoV-2 neutralizing antibody structures inform therapeutic strategies. Nature (2020). doi:10.1038/s41586-020-2852-1
- (7) Cheng MH et al. Impact of South African 501.V2 Variant on SARS-CoV-2 Spike Infectivity and Neutralization: A Structure-based Computational Assessment. bioRxiv 2021.01.10.426143 (2021). doi:10.1101/2021.01.10.426143
- (8) Garcia-Beltran WF et al. Circulating SARS-CoV-2 variants escape neutralization by vaccine-induced humoral immunity. medRxiv 2021.02.14.21251704 (2021). doi:10.1101/2021.02.14.21251704
- (9) Yuan M et al. A highly conserved cryptic epitope in the receptor binding domains of SARS-CoV-2 and SARS-CoV. Science 368, 630–633 (2020).
- (10) Taylor, P.C., Adams, A.C., Hufford, M.M. et al. Neutralizing monoclonal antibodies for treatment of COVID-19. Nat Rev Immunol (2021). https://doi.org/10.1038/s41577-021-00542-x
- (11) Emily Engelhart, Randolph Lopez, Ryan Emerson, Charles Lin, Colleen Shikany, Daniel Guion, Mary Kelley, David Younger. Massively Multiplexed Affinity Characterization of Therapeutic Antibodies Against SARS-CoV-2 Variants. Preprint. bioRxiv 2021.04.27.440939; doi: https://doi.org/10.1101/2021.04.27.440939





