FACS Antibodies
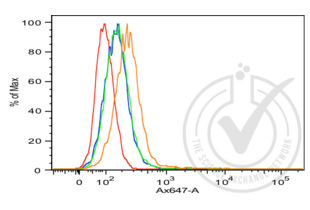
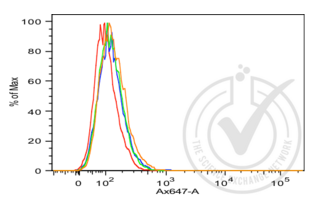
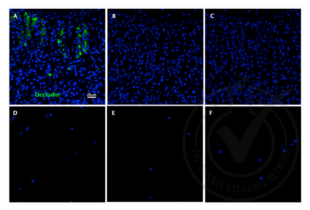
Le tri cellulaire activé par fluorescence (FACS) est un type spécialisé de cytométrie de flux. Il permet de trier un mélange hétérogène de cellules biologiques dans deux conteneurs ou plus, une cellule à la fois, sur la base des caractéristiques spécifiques de diffusion de la lumière et de fluorescence de chaque cellule et des anticorps qui y sont fixés.
Important Targets
All Flow Cytometry Antibodies
Filtrer les résultats:
77.485 Résultats :
 356 références
356 références
 1 validation
1 validation
 270 références
270 références
 16 références
16 références
 1 validation
1 validation
 14 références
14 références
 1 validation
1 validation
 15 références
15 références
 1 validation
1 validation
 10 références
10 références
 3 validations
3 validations
 13 références
13 références
 1 validation
1 validation
 11 références
11 références
 1 validation
1 validation
 4 références
4 références
 1 validation
1 validation
 5 références
5 références
 1 validation
1 validation