La maladie d'Alzheimer
La maladie d'Alzheimer (MA) est la forme de démence la plus courante. Environ 50 millions de personnes dans le monde souffrent de MA. Une nouvelle augmentation du nombre de cas est attendue d’ici 2050, en partie en raison de l’augmentation fondamentale de l’espérance de vie. Le tableau clinique est caractérisé par une perte progressive des capacités cognitives. Les caractéristiques neurologiques sont la présence de plaques neuritiques et d'enchevêtrements neurofibrillaires de protéines dans le tissu cérébral. En fin de compte, la maladie entraîne la mort.
La majorité des cas sporadiques de MA restent génétiquement inexpliqués et seraient principalement influencés par des facteurs non génétiques tels que le stress oxydatif, le dysfonctionnement mitochondrial, la neuroinflammation ou des facteurs microbiens (par exemple HSV-1).
Cependant, dans certaines formes de MA à apparition précoce et tardive, des mutations pathogènes sous-jacentes dans plusieurs gènes et leurs protéines respectives ont été identifiées comme facteurs de risque génétiques de développement de la MA familiale. Par exemple, la présence de l’allèle ε4 du gène de l’apolipoprotéine E (APOE4) augmente le risque de maladie d’Alzheimer tardive à partir du milieu des années 60. La MA à début précoce survenant dès le milieu de la trentaine est moins fréquente et les altérations génétiques observées dans ce contexte concernent le gène de la protéine précurseur amyloïde (APP) et les gènes Préséniline 1 (PSEN1) et 2 (PSEN2). Les oligomères Aβ et Tau hyperphosphorylés (pTau) sont considérés comme des déterminants de la physiopathologie de la MA, bien que le mécanisme exact ne soit pas encore compris.
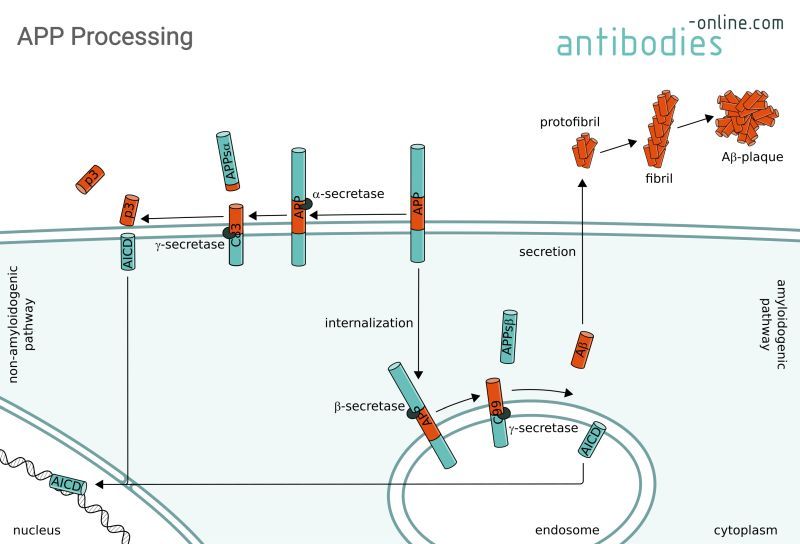
L’APP est l’un des facteurs clés de la MA et au cœur de l’hypothèse amyloïde en tant que cause sous-jacente de la maladie. Il est principalement traité protéolytiquement par l'α-sécrétase et la γ-sécrétase dans la membrane plasmique (voie non amyloïdogène, à gauche). Les produits finaux sont le fragment N-terminal extracellulaire soluble (APPsα) et le peptide p3 ainsi que le domaine intracellulaire APP N-terminal (AICD). Le traitement a lieu dans la membrane de l'endosome via la voie amyloïdogène (à droite) par l'Aβ- et l'Aγ-sécrétase en APPsβ N-terminaux, en peptides Aβ et en AICD. L'AICD agit comme facteur de transcription lors du transport dans le noyau. Les peptides Aβ comprenant 38 à 43 acides aminés sont sécrétés dans l'espace intracellulaire où ils forment des fibrilles et finalement les plaques Aβ caractéristiques de la MA.
- Apolipoprotein E
- Amyloid Precursor Protein
- Tau
- α-synuclein
Facteurs clés de la MA :
Cibles importantes liées à la maladie d'Alzheimer
D’après la littérature récente, certaines des cibles les plus intéressantes pour la recherche sur la MA sont :
Apolipoprotein E
La variante APOE4 du gène de l'apolipoprotéine E sur le chromosome 19 est le principal facteur de risque génétique de la MA à apparition tardive. Il s'agit de l'une des trois versions différentes du gène APOE : APOE2 est la plus rare des trois variantes et est associée à un risque réduit de MA. APOE3 est la variante la plus courante et ne semble pas influencer le développement de la MA. APOE4, en revanche, est un facteur de risque majeur de MA familiale à apparition tardive. Cela provoque des modifications de la barrière hémato-encéphalique qui entraînent des problèmes au niveau des synapses.
La prévalence du variant APOE4 dans la population générale se situe autour de 9 à 23 %. En comparaison, au moins une copie d'APOE4 est présente chez 24 à 45 % des patients atteints de MA et 2 à 3 % ont deux copies de l'allèle (homozygotie) selon l'origine ethnique. L'homozygotie pour cet allèle entraîne une apparition plus précoce de la maladie que chez les porteurs hétérozygotes et prédit la MA à 80 ans.
Anticorps APOE
Amyloid Precursor Protein
La protéolyse du récepteur de surface transmembranaire APP donne naissance à divers peptides bêta-amyloïde (Aβ). Les mutations du gène APP sur le chromosome 21 peuvent altérer les sites de clivage des protéases β-sécrétase (BACE1) et γ-sécrétase (PSEN1, PSEN2, NCSTN, APH1A, APH1B, PSENEN) et augmenter la quantité totale d'Aβ dans la cellule ou le rapport de l'Aβ42/Aβ40. De même, des mutations dans le promoteur APP ou la duplication du gène provoquent une concentration élevée d’Aβ. En revanche, une mutation protectrice du gène AAP peut réduire le risque de MA. Plusieurs protéines sont également connues pour moduler l'expression de l'APP, par ex. APOE, ABCA7, BIN1, clusterine, PICALM et SORLA.
L’augmentation de l’Aβ total et du rapport Aβ42/Aβ40 conduit à la formation de plaques amyloïdes neuritiques extracellulaires caractéristiques de la MA en raison de la tendance des protéines – en particulier de l’Aβ42 – à s’oligomériser et à partir de fibrilles insolubles. L’hypothèse amyloïde postule que cet agglomération de peptides Aβ est le principal moteur de la MA. Les médicaments anti-MA tels que le lécanemab, le donanemab, l’aducanumab et les anticorps monoclonaux du ganténérumab visent à éliminer l’amyloïde du cerveau. Certains d'entre eux ont montré des effets médiocres dans l'atténuation des effets de la MA à des stades ultérieurs, mais ont ralenti le déclin cognitif et fonctionnel chez les personnes atteintes de MA symptomatique précoce lors d'essais cliniques. Des approches pharmacologiques alternatives ciblent la β-sécrétase et la γ-sécrétase pour prévenir la protéolyse de l'APP.
Les peptides APP et Aβ influencent également la stabilité des synapses grâce à leur interaction avec la voie de signalisation Wnt. D'une part, l'APP active la Wnt-b-caténine canonique, importante pour la stabilité des synapses, par l'induction de l'inhibiteur de Wnt Dkk1 par Aβ. D'autre part, Aβ peut également activer la signalisation Wnt non canonique, ce qui conduit à la rétraction des synapses. L'activation de cette voie de signalisation non canonique Wnt augmente également la production d'Aβ, entraînant une boucle de rétroaction positive qui conduit finalement à une perte de synapse.
La neuroinflammation provoquée par les produits de protéolyse APP est un aspect supplémentaire de la MA. Aβ se lie également aux récepteurs de reconnaissance de formes (PRR) des microglies, les principales cellules immunitaires du système nerveux central (SNC). Lors de la reconnaissance de l'Aβ en tant que modèles moléculaires associés aux dommages (DAMP), les microglies au repos sont activées. Cela déclenche la libération de cytokines pour améliorer la phagocytose ainsi que l'absorption et la clairance de l'Aβ, inhiber les processus inflammatoires et favoriser la réparation des tissus. Cependant, l’activation à long terme des microglies donne lieu à une neuroinflammation provoquant un dysfonctionnement synaptique et une neurotoxicité qui exacerbe la neurodégénérescence.
Anticorps Aβ
β- et γ-Secretase
Les mécanismes de génération et de prévention de l'Aβ font l'objet de recherches intensives. L'APP, ainsi que les β- et γ-sécrétases, sont les principaux acteurs impliqués dans la production d'Aβ, tandis que le clivage de l'α-sécrétase sur l'APP empêche le dépôt d'Aβ. Les inhibiteurs ou modulateurs qui ciblent les β- et γ-sécrétases ainsi que les activateurs de l'α-sécrétase sont des candidats prometteurs pour le traitement de la MA.
Anticorps β-secretase et γ-Secretase
Tau
Tau est une phosphoprotéine associée aux microtubules, abondante dans les axones et impliquée dans la promotion de la polymérisation et de la stabilisation des microtubules. De nombreuses maladies neurodégénératives présentent des altérations de Tau et une pathologie caractérisée par des enchevêtrements neurobribrillaires intraneuraux composés d'oligomères de pTau. La MA est considérée comme une tauopathie secondaire car le principal moteur de la maladie est l’agglutination des produits de protéolyse Aβ.
De nombreuses kinases, notamment GSK3β, CDK5, MAPK, JNK et p38, régulent finement l'hyperméthylation de la protéine Tau. Cela conduit à un changement de conformation qui altère son association avec les microtubules. Par conséquent, Tau devient soluble et peut subir une dimérisation et une auto-association en oligomères d'ordre supérieur, en filaments (alias filaments hélicoïdaux appariés, PHF) et finalement en NFT (enchevêtrements neurofibrillaires). Les chaperons tels que Hsp70 et DNAJA1 peuvent réduire l'agrégation de Tau et sont à leur tour modulés par Cereblon (CRBN).
Anticorps Tau
α-synuclein
La protéine présynaptique α-synucléine (αSyn) est traditionnellement associée à des synucléopathies comme la maladie de Parkinson (MP) ou la démence à corps de Lewy (DLB). Plus récemment, il a été suggéré que αSyn pourrait également jouer un rôle dans la MA en raison des niveaux élevés de protéine dans le liquide céphalorachidien des individus présentant un risque élevé de TAS et de preuves expérimentales liant αSyn à l'hyperphosphorylation de la protéine tau.
Anticorps α-synuclein
Lysats cellulaires pour la recherche sur la maladie d'Alzheimer
Nous proposons une variété de lysats pour la recherche sur la MA :
Références Littéraires
- : "The role of tau in Alzheimer's disease and related disorders." dans: CNS neuroscience & therapeutics, Vol. 17, Issue 5, pp. 514-24, (2012) (PubMed).
- : "Alpha, beta-and gamma-secretases in Alzheimer's disease." dans: Frontiers in bioscience (Scholar edition), Vol. 4, Issue 3, pp. 1126-50, (2013) (PubMed).
- : "The importance of tau phosphorylation for neurodegenerative diseases." dans: Frontiers in neurology, Vol. 4, pp. 83, (2013) (PubMed).
- : "The patterns of inheritance in early-onset dementia: Alzheimer's disease and frontotemporal dementia." dans: American journal of Alzheimer's disease and other dementias, Vol. 30, Issue 3, pp. 299-306, (2016) (PubMed).
- : "Herpes simplex infection and the risk of Alzheimer's disease: A nested case-control study." dans: Alzheimer's & dementia : the journal of the Alzheimer's Association, Vol. 11, Issue 6, pp. 587-92, (2016) (PubMed).
- : "Amyloid β: one of three danger-associated molecules that are secondary inducers of the proinflammatory cytokines that mediate Alzheimer's disease." dans: British journal of pharmacology, Vol. 172, Issue 15, pp. 3714-27, (2016) (PubMed).
- : "A role for APP in Wnt signalling links synapse loss with β-amyloid production." dans: Translational psychiatry, Vol. 8, Issue 1, pp. 179, (2019) (PubMed).
- : "SNAP-25 in Serum Is Carried by Exosomes of Neuronal Origin and Is a Potential Biomarker of Alzheimer's Disease." dans: Molecular neurobiology, Vol. 56, Issue 8, pp. 5792-5798, (2019) (PubMed).
- : "α-synuclein in the pathophysiology of Alzheimer's disease." dans: Molecular neurodegeneration, Vol. 14, Issue 1, pp. 23, (2020) (PubMed).
- : "APOE4 exacerbates α-synuclein pathology and related toxicity independent of amyloid." dans: Science translational medicine, Vol. 12, Issue 529, (2021) (PubMed).
- : "Herpes Simplex Virus-1 in the Brain: The Dark Side of a Sneaky Infection." dans: Trends in microbiology, Vol. 28, Issue 10, pp. 808-820, (2021) (PubMed).
- : "Targeting Amyloidogenic Processing of APP in Alzheimer's Disease." dans: Frontiers in molecular neuroscience, Vol. 13, pp. 137, (2020) (PubMed).
- : "The APOE ε4 exerts differential effects on familial and other subtypes of Alzheimer's disease." dans: Alzheimer's & dementia : the journal of the Alzheimer's Association, Vol. 16, Issue 12, pp. 1613-1623, (2021) (PubMed).
- : "Cereblon Regulates the Proteotoxicity of Tau by Tuning the Chaperone Activity of DNAJA1." dans: The Journal of neuroscience : the official journal of the Society for Neuroscience, Vol. 41, Issue 24, pp. 5138-5156, (2021) (PubMed).
- : "TDP-43 Pathology in Alzheimer's Disease." dans: Molecular neurodegeneration, Vol. 16, Issue 1, pp. 84, (2022) (PubMed).
- : "Resilience to autosomal dominant Alzheimer's disease in a Reelin-COLBOS heterozygous man." dans: Nature medicine, Vol. 29, Issue 5, pp. 1243-1252, (2023) (PubMed).
- : "Platelet-derived exerkine CXCL4/platelet factor 4 rejuvenates hippocampal neurogenesis and restores cognitive function in aged mice." dans: Nature communications, Vol. 14, Issue 1, pp. 4375, (2023) (PubMed).
- : "Plasma proteomic profiles predict future dementia in healthy adults." dans: Nature aging, (2024) (PubMed).
Références Supplémentaires
- Alzheimer’s Research UK. Dementia Statistics Hub - Global Prevalence. Internet: www.dementiastatistics.org/statistics/global-prevalence/
- Alzheimer’s Risk Gene Paradoxically Protects Against Memory Loss. The Scientist. Internet: www.the-scientist.com/news-opinion/alzheimer-s-risk-gene-paradoxically-protects-against-memory-loss-69296
- AlzPedia. AlzForum - Networking for a cure. Internet: www.alzforum.org/alzpedia

Goal-oriented, time line driven scientist, proficiently trained in different academic institutions in Germany, France and the USA. Experienced in the life sciences e-commerce environment with a focus on product development and customer relation management.
Go to author page



