Amyotrophic Lateral Sclerosis
Elle a été décrite pour la première fois en 1869 par le neurologue français Jean-Martin Charcot (maladie de Charcot) et est devenue célèbre à la fin des années 1930 lorsque le joueur de baseball Lou Gehrig a été diagnostiqué comme étant atteint de cette maladie (maladie de Lou Gehrig).
La plupart des cas de SLA sont sporadiques (SALS), mais 5 à 10 % des cas sont des SLA familiales (FALS) avec une cause génétique sous-jacente. Les symptômes apparaissent généralement vers 60 ans pour la SLA et vers 50 ans pour la SLA familiale. Le SALS et le FALS sont tous deux causés par une dégénérescence progressive des motoneurones corticaux et spinaux, entraînant une paralysie et, à terme, une insuffisance respiratoire en raison de l'affaiblissement des muscles. Des mutations dans de nombreux gènes ont été associées à des mécanismes provoquant la dégénérescence neuronale, tels que la dysrégulation de l'ARN, l'altération de l'homéostasie des protéines ou la formation d'agrégats cytoplasmiques. Nombre de ces marques génétiques sont partagées avec la démence frontotemporale (DFT), une maladie étroitement apparentée. Les cellules non neuronales, telles que les astrocytes et la microglie, exacerbent la neurodégénérescence par la sécrétion de médiateurs neurotoxiques et la modulation de l'expression des récepteurs du glutamate. Le dysfonctionnement des oligodendrocytes et des cellules de Schwann provoque des lésions de la myéline.
Outre la prédisposition génétique, on pense que des facteurs environnementaux contribuent au développement de la SLA, étant donné que la maladie se manifeste généralement à l'âge adulte. Les facteurs de risque présumés sont, entre autres, le tabagisme, les traumatismes crâniens, la propension à faire du sport et les produits chimiques neurotoxiques, par exemple la b-N-méthylamino-L-alanine (BMMA).
A ce jour, il n'existe pas de traitement efficace de la SLA. Jusqu'à présent, il n'existe pas de traitement efficace de la SLA. Les principales options sont le traitement neuroprotecteur, le traitement symptomatique et de soutien, ainsi que certaines thérapies de modification de la maladie qui n'ont pas encore fait leurs preuves, telles que la transplantation de cellules souches et la thérapie génique.
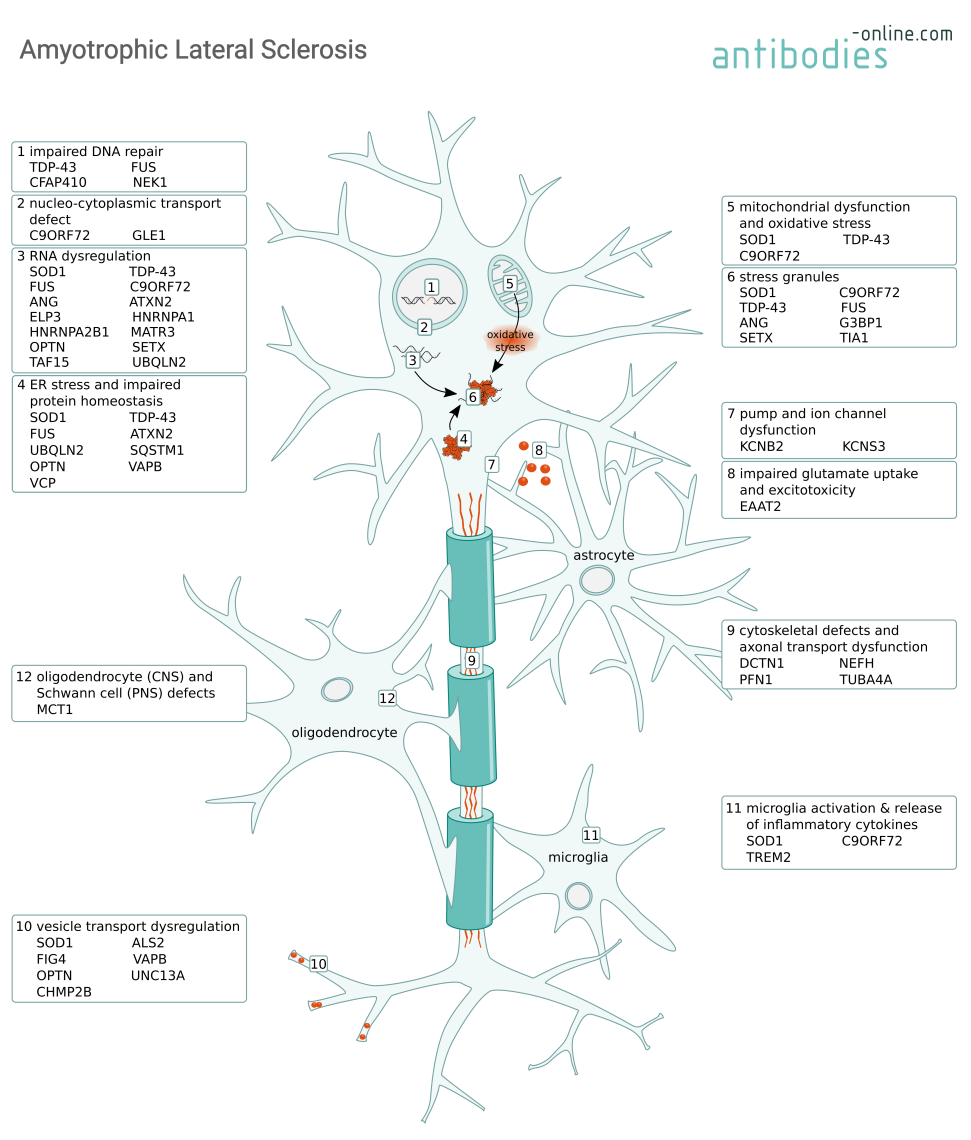
Mécanismes à l'origine de la dégénérescence des motoneurones dans la SLA et certaines des protéines impliquées.
Cibles importantes liées à la sclérose latérale amyotrophique
Plus de 140 gènes ont été identifiés comme étant à l'origine de la SLA, comme étant associés à la SLA ou comme influençant la progression de la maladie :
C9ORF72
C9ORF72 est une protéine abondante dans les neurones qui fait partie du complexe protéique C9ORF7-SMCR. On pense qu'elle a une activité de facteur d'échange de nucléotides guaninés, qu'elle régule l'autophagie et qu'elle joue un rôle dans le trafic endosomal. Les mutations du gène C9orf72 sont le plus souvent associées à la SLA (jusqu'à 50 % des cas de FALS et 10 % des cas de SALS).
Trois mécanismes contribueraient à la pathologie de la SLA en fonction des mutations du gène C9ORF72. Premièrement, l'expansion d'une répétition GGGGCC au sein du promoteur de C9orf72 entraîne une diminution de l'expression de la protéine et, par conséquent, une perte de fonction. Deuxièmement, l'accumulation de transcrits d'ARN contenant des répétitions GGGGCC conduit à la formation d'agrégats d'ARN toxiques qui séquestrent encore d'autres protéines liant l'ARN et conduisent à un dérèglement de l'homéostasie protéique et à la formation de granules de stress. Et troisièmement, un gain de fonction toxique lorsque les répétitions hexanucléotidiques GGGGCC sont traduites en protéines contenant des répétitions dipeptidiques (DPR). Ces peptides poly-GA, poly-GP, poly-GR, poly-PA et poly-PR (selon le cadre de lecture) forment des inclusions DPR qui entravent le transport nucléocytoplasmique et peuvent provoquer une neurodégénérescence. Ces mécanismes proposés ne s'excluent pas mutuellement et leurs contributions relatives sont encore à l'étude.
C9ORF72 Anticorps
SOD1
Les études génétiques ont identifié les mutations de la superoxyde dismutase (SOD1) comme la deuxième cause la plus fréquente de FALS avec une proportion de 10 à 20 %.
Les mutations de la superoxyde dismutase (SOD1) ont été identifiées comme la deuxième cause la plus fréquente de FALS avec une proportion de 10 à 20 %.
La SOD1 est une enzyme hautement exprimée, principalement cytosolique, qui catalyse la conversion du superoxyde en peroxyde d'hydrogène et en oxygène. La SOD1 mutante se lie aux mitochondries et compromet la respiration en bloquant l'importation des protéines. Cela provoque un stress oxydatif, un déséquilibre de l'homéostasie cellulaire du Ca2+, la formation d'agrégats intracellulaires et de granules de stress. Ces agrégats conduisent à l'agrégation des neurofilaments et affectent négativement les processus de transport axonal. En fin de compte, la SOD1 mutante peut induire l'apoptose via l'inhibition de Bcl-2.
SOD1 Anticorps
TDP-43
Les mutations de la protéine de liaison TAR-ADN 43 kDa (TDP-43), codée par le gène TARDBP, sont moins fréquentes que la RPD C9ORF72 ou les mutations de la SOD1. Cependant, sa mauvaise localisation dans le cytoplasme est un élément caractéristique dans de nombreux cas de SLA.
La protéine TDP-43, codée par le gène TARDBP, est moins fréquente que les mutations du C9ORF72 DPR ou de la SOD1.
TDP-43 est une protéine nucléaire essentielle se liant à l'ADN et à l'ARN, impliquée dans la régulation de la transcription, la modulation de l'épissage des gènes, le métabolisme de l'ARN et les granules de stress. Dans la SLA familiale et sporadique et dans d'autres maladies neurodégénératives telles que la démence frontotemporale (DFT) ou la maladie d'Alzheimer (MA), les formes mutées de TDP-43 sont un composant majeur des agrégats de protéines ubiquitinées insolubles dans le cytoplasme. Ces agrégats de TDP-43 séquestrent les miARN et les protéines, altérant ainsi l'homéostasie protéique. La dysrégulation des protéines mitochondriales codées par le noyau entraîne un dysfonctionnement mitochondrial et un stress oxydatif
.L'élimination de la TDP-43 n'est pas une approche thérapeutique viable en raison de la fonction cellulaire critique de la protéine. Il a cependant été démontré que la diminution de l'expression de l'ataxine 2 (ATXN2) à l'aide d'oligonucléotides antisens (ASO) réduit également la toxicité de la TDP-43.
TDP-43/TARDBP Anticorps
FUS
Similaire à TDP-43, FUS (fused in sarcoma) est une protéine de liaison à l'ARN impliquée dans la transcription et le traitement de l'ARN. Conformément à sa fonction, la protéine FUS de type sauvage est située dans le noyau. Dans la SLA cependant, les formes mutées de la protéine sont mal localisées dans le cytoplasme. Ici, les mutations de gain de fonction peuvent provoquer l'agrégation de FUS et des protéines de liaison à l'ARN associées, conduisant ainsi à un déséquilibre de l'homéostasie des protéines, à une dysrégulation de l'ARN et à la formation de granules de stress qui conduisent finalement à la perte du motoneurone.
Les mutations de FUS sont des mutations de l'ARN qui peuvent entraîner une perte de la protéine.
Les mutations de FUS sont présentes dans environ 5 % des cas de FALS et moins de 2 % des cas de SALS. Elles sont fréquemment associées à la SLA à début précoce. En raison de l'effet toxique dose-dépendant des variantes mutées de FUS, la protéine est une cible thérapeutique potentielle pour le silençage par oligonucléotides antisens.
Les mutations de FUS sont présentes dans environ 5 % des cas de FALS et dans moins de 2 % des cas de SALS.
FUS Anticorps
Références
- : "Ataxin-2 intermediate-length polyglutamine expansions are associated with increased risk for ALS." dans: Nature, Vol. 466, Issue 7310, pp. 1069-75, (2010) (PubMed).
- : "A comprehensive review of amyotrophic lateral sclerosis." dans: Surgical neurology international, Vol. 6, pp. 171, (2015) (PubMed).
- : "An amyotrophic lateral sclerosis-linked mutation in GLE1 alters the cellular pool of human Gle1 functional isoforms." dans: Advances in biological regulation, Vol. 62, pp. 25-36, (2017) (PubMed).
- : "Decoding ALS: from genes to mechanism." dans: Nature, Vol. 539, Issue 7628, pp. 197-206, (2016) (PubMed).
- : "Pathology of Neurodegenerative Diseases." dans: Cold Spring Harbor perspectives in biology, Vol. 9, Issue 7, (2018) (PubMed).
- : "The Role of Dipeptide Repeats in C9ORF72-Related ALS-FTD." dans: Frontiers in molecular neuroscience, Vol. 10, pp. 35, (2017) (PubMed).
- : "Therapeutic reduction of ataxin-2 extends lifespan and reduces pathology in TDP-43 mice." dans: Nature, Vol. 544, Issue 7650, pp. 367-371, (2017) (PubMed).
- : "Dysregulated molecular pathways in amyotrophic lateral sclerosis-frontotemporal dementia spectrum disorder." dans: The EMBO journal, Vol. 36, Issue 20, pp. 2931-2950, (2017) (PubMed).
- : "ALS Genes in the Genomic Era and their Implications for FTD." dans: Trends in genetics : TIG, Vol. 34, Issue 6, pp. 404-423, (2019) (PubMed).
- : "Amyotrophic Lateral Sclerosis: An Update for 2018." dans: Mayo Clinic proceedings, Vol. 93, Issue 11, pp. 1617-1628, (2019) (PubMed).
- : "RNA Dysregulation in Amyotrophic Lateral Sclerosis." dans: Frontiers in genetics, Vol. 9, pp. 712, (2018) (PubMed).
- : "Impaired NHEJ repair in amyotrophic lateral sclerosis is associated with TDP-43 mutations." dans: Molecular neurodegeneration, Vol. 15, Issue 1, pp. 51, (2021) (PubMed).
- : "Spatiotemporal Proteomic Analysis of Stress Granule Disassembly Using APEX Reveals Regulation by SUMOylation and Links to ALS Pathogenesis." dans: Molecular cell, Vol. 80, Issue 5, pp. 876-891.e6, (2020) (PubMed).
- : "Stress Granule Dysregulation in Amyotrophic Lateral Sclerosis." dans: Frontiers in cellular neuroscience, Vol. 14, pp. 598517, (2020) (PubMed).
- : "Improving clinical trial outcomes in amyotrophic lateral sclerosis." dans: Nature reviews. Neurology, Vol. 17, Issue 2, pp. 104-118, (2021) (PubMed).
- : "TDP-43 aggregation induced by oxidative stress causes global mitochondrial imbalance in ALS." dans: Nature structural & molecular biology, Vol. 28, Issue 2, pp. 132-142, (2021) (PubMed).
- : "Oligodendrocyte Dysfunction in Amyotrophic Lateral Sclerosis: Mechanisms and Therapeutic Perspectives." dans: Cells, Vol. 10, Issue 3, (2021) (PubMed).
- : "Microglial TREM2 in amyotrophic lateral sclerosis." dans: Developmental neurobiology, Vol. 82, Issue 1, pp. 125-137, (2022) (PubMed).
- : "TREM2 interacts with TDP-43 and mediates microglial neuroprotection against TDP-43-related neurodegeneration." dans: Nature neuroscience, Vol. 25, Issue 1, pp. 26-38, (2022) (PubMed).
- : "Antisense oligonucleotide silencing of FUS expression as a therapeutic approach in amyotrophic lateral sclerosis." dans: Nature medicine, Vol. 28, Issue 1, pp. 104-116, (2022) (PubMed).
- : "Apolipoprotein A1 Enhances Endothelial Cell Survival in an In Vitro Model of ALS." dans: eNeuro, Vol. 9, Issue 4, (2022) (PubMed).
- : "Elevated α5 integrin expression on myeloid cells in motor areas in amyotrophic lateral sclerosis is a therapeutic target." dans: Proceedings of the National Academy of Sciences of the United States of America, Vol. 120, Issue 32, pp. e2306731120, (2023) (PubMed).

Goal-oriented, time line driven scientist, proficiently trained in different academic institutions in Germany, France and the USA. Experienced in the life sciences e-commerce environment with a focus on product development and customer relation management.
Go to author page



