Maladie de Parkinson
La Maladie de Parkinson (MP) est la deuxième maladie neurodégénérative la plus répandue. Il s'agit d'un trouble chronique progressif du système nerveux central, caractérisé par quatre symptômes moteurs cardinaux : tremblements, bradykinésie, rigidité et instabilité posturale. Avec la progression de la maladie, des symptômes non moteurs peuvent également apparaître, notamment un déclin cognitif, une altération du comportement et des troubles du sommeil. La MP apparaît généralement à l'âge de 60 ans et plus avec une incidence d'environ 150 à 200/100.000 individus. Elle est plus répandue chez les hommes que chez les femmes. La plupart des cas de MP sont causés par des facteurs environnementaux. Cependant, 10 à 15% des cas sont des MP familiales à apparition précoce et des études associées à l’échelle du génome ont identifié plus de 40 facteurs de risque génétiques.
Au niveau cellulaire, la MP se caractérise par la perte progressive des neurones dopaminergiques dans la substance noire pars compacta (SNc), une région du mésencéphale responsable du contrôle moteur. La dégénérescence de ces neurones entraîne une diminution de la production de dopamine et une altération de la signalisation dans le striatum des noyaux gris centraux, contribuant au contrôle de la motricité fine. Les symptômes moteurs apparaissent généralement lorsque 50 à 80% des neurones dopaminergiques SNc ont dégénéré. Chaque côté du SNc humain ne contient que 400.000 à 500.000 neurones dopaminergiques.
Les principaux facteurs de risque de la MP sont le vieillissement et les facteurs environnementaux, notamment les poisons mitochondriaux, les métaux lourds, les pesticides ou les traumatismes crâniens. Le métabolisme oxydatif de la dopamine dans les cellules dopaminergiques par les isoformes mitochondriales de la monoamine oxydase MAOA et MAOB conduit à la génération d'espèces réactives de l'oxygène (ROS), à des dommages oxydatifs et finalement à la mort cellulaire. En raison de leur activité métabolique élevée, les neurones dopaminergiques du SNc seraient particulièrement sensibles au stress oxydatif.
Outre les causes idiopathiques, des mutations dans plusieurs gènes ont été identifiées comme facteurs de susceptibilité à la MP ou associées à des formes autosomiques dominantes ou récessives de la maladie.
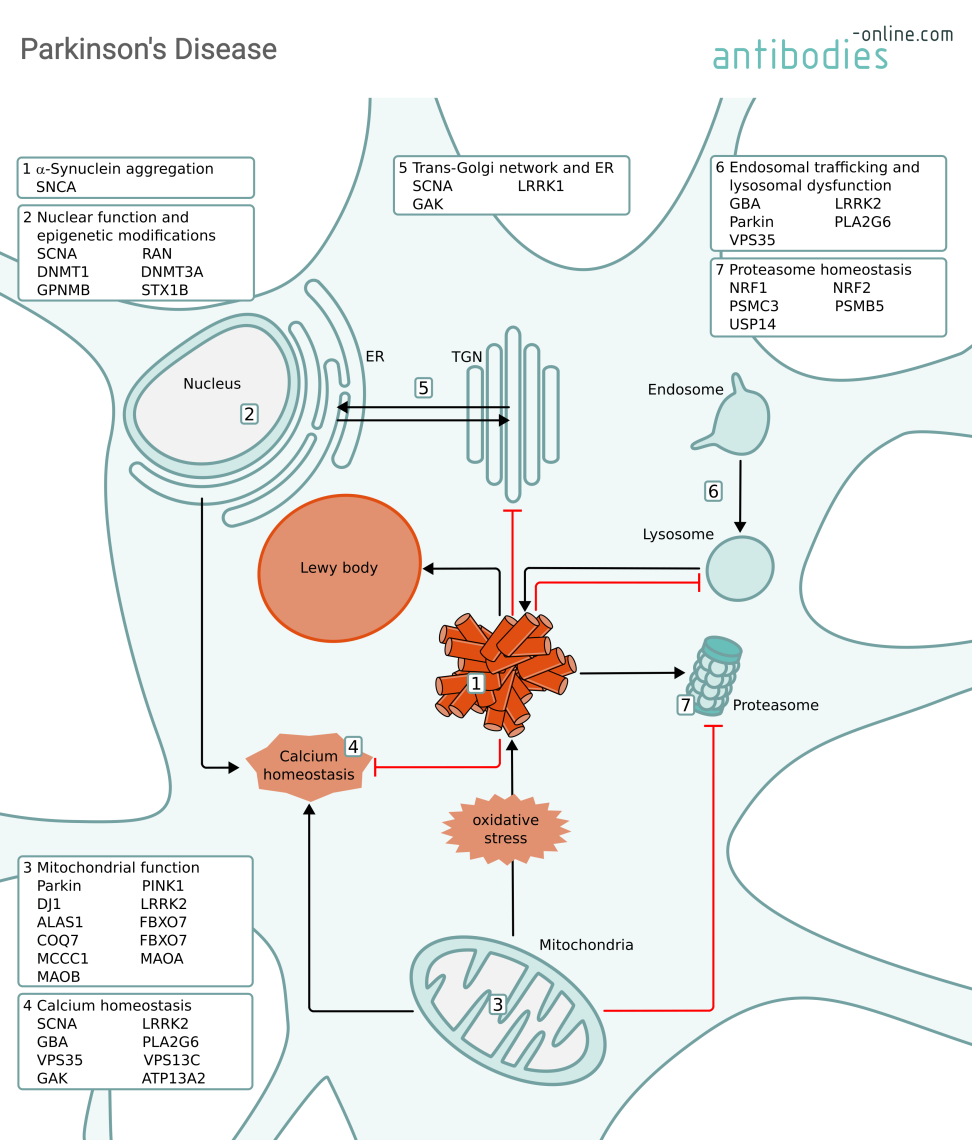
Mécanismes provoquant la dégénérescence des neurones dans la MP et certaines des protéines impliquées.
Cibles importantes liées à la maladie de Parkinson
Plus de 40 protéines ont été associées à la MP, notamment :
SNCA
L'alpha-synucléine (SNCA, locus autosomique dominant PARK1) est une protéine neuronale abondante dans le cerveau humain qui régule le trafic des vésicules synaptiques et la libération ultérieure des neurotransmetteurs. La MP est classée comme une synucléopathie en raison de l’agrégation caractéristique d’alpha-synucléine mal repliée.
Dans des conditions pathologiques, les ROS peuvent médier les changements conformationnels de l'alpha-synucléine normale en agrégats non fibrillaires mal repliés. Normalement, la protéine alpha-synucléine mal repliée est marquée et dégradée par le système ubiquitine-protéasome et les plus gros agrégats subissent une dégradation lysosomale. Ils peuvent cependant également former des agrégats plus gros et des amas insolubles appelés corps de Lewy. Les corps de Lewy (LB) sont également présents dans la démence neurodégénérative à corps de Lewy, qui partage les symptômes de la MP. L'étendue de la pathologie LB est prise en compte dans la stadification de Braak de la MP.
L'alpha-synucléine mal repliée dans un neurone peut induire un mauvais repliement de l'alpha-synucléine dans les neurones voisins. Cette pathologie qui se propage est peut-être à l'origine de la nature évolutive de la maladie de Parkinson. L'alpha-synucléine mal repliée peut perturber divers processus cellulaires, tels que la dégradation des protéines et la fonction mitochondriale, conduisant à un dysfonctionnement cellulaire et à un stress oxydatif supplémentaire qui alimente davantage la pathologie. On pense que la toxicité neuronale causée par l’accumulation d’alpha-synucléine mal repliée contribue à la dégénérescence des neurones dopaminergiques dans le SNc.
Enfin, les agrégats d’alpha-synucléine mal repliée hyperactivent la signalisation MAPK, favorisant ainsi la neuroinflammation. L'inflammation contribue en outre à la dégénérescence des neurones et à la progression de la maladie.
La formation initiale d’agrégats d’alpha-synucléine est généralement déclenchée par des facteurs provoquant un stress cellulaire et oxydatif. Cependant, la formation de ces agrégats peut également être favorisée par certaines mutations ponctuelles du gène SNCA. Des facteurs épigénétiques tels qu'un faible niveau de méthylation de deux îlots CpG dans le gène SNCA ont été impliqués comme facteurs contribuant à la MP.
Anticorps SNCA
GBA
Le gène GBA code pour l'enzyme lysosomale bêta-glucocérébrosidase (Beta-GC) qui joue un rôle central dans le renouvellement de la membrane cellulaire et la dégradation des lipides complexes. Les mutations de ce gène constituent le facteur de risque génétique de MP le plus courant : jusqu’à 10% des patients atteints de la maladie de Parkinson présentent une mutation de la GBA, contre 1% de la population non affectée. La mutation hétérozygote GBA augmente le risque de maladie de Parkinson de cinq à huit fois. Au total, on connaît plus de 100 variantes du gène GBA qui réduisent l’activité enzymatique de la protéine, la déstabilisent ou modifient sa localisation lysosomale.
L’accumulation du glucocérébroside, substrat du bêta-GC, dans les lysosomes entraîne un dysfonctionnement lysosomal et contribuerait à l’agrégation de l’alpha-synucléine et exacerberait davantage la neuroinflammation.
Les porteurs hétérozygotes de la mutation GBA présentent un risque de maladie de Parkinson cinq à huit fois plus élevé selon la variante. Les mutations homozygotes de la GBA provoquent la maladie de Gaucher (sphingolipidose), un trouble de stockage lysosomal qui affecte principalement le foie, la rate et les os. Au-delà de ces organes, la MG peut également se manifester dans le système nerveux central et les patients atteints de MG sont classés en trois types en fonction de l'atteinte cérébrale et des symptômes neurologiques.
Anticorps GBA
LRRK2
La Leucine-Rich Repeat Kinase 2 (LRRK2, locus autosomique dominant PARK8) est une protéine complexe de 253 kDa avec de multiples domaines et activités qui s'exprime dans le cerveau, les poumons, les reins et le système immunitaire. LRRK2 possède à la fois des activités GTPase et kinase. Les mutations du gène LRRK2 constituent le deuxième facteur de risque génétique le plus courant de MP sporadique et représentent jusqu'à 1% des cas de MP. Les mutations de LRRK2 font également partie des causes les plus courantes de MP familiale et les individus qui héritent de mutations de gain de fonction dans LRRK2 courent un risque plus élevé de développer la maladie plus tard dans la vie. On pense que l’activité accrue de la kinase est à l’origine de l’effet pathogène du variant LRRK2 associé à la MP.
En raison de la large gamme de substrats de kinases, la neuropathologie de LRRK2 est très diversifiée. Les mutations LRRK2 peuvent influencer l’alpha-synucléine et ont été associées à la neuroinflammation et au dysfonctionnement des mitochondries et de l’ubiquitine-protéasome – tous des facteurs contribuant à la MP.
Des recherches récentes ont montré que les inhibiteurs de LRRK2 à petites molécules peuvent être neuroprotecteurs, ce qui suggère que les thérapies ciblant LRRK2 pourraient être bénéfiques chez une population plus large de patients.
Anticorps LRRK2
VPS35
La protéine vacuolaire 35 (VPS35, locus autosomique dominant PARK17) fait partie du complexe protéique rétromère, responsable du tri des protéines de l'endosome à la membrane cellulaire et au réseau trans-Golgi. VPS35 recrute le complexe WASH dans la membrane endosomale, nécessaire au tri des protéines endosomales.
La mutation VPS35 D620N est présente chez 0,1 à 1% des patients atteints de MP familiale. Il a été démontré que ce mutant s'associe mal au complexe WASH et compromet son recrutement dans l'endosome. VPS35 D620N a également été impliqué dans un dysfonctionnement mitochondrial. Par conséquent, des mutations dans VPS35 pourraient contribuer à la MP par une activité lysosomale perturbée et, par conséquent, par l’accumulation d’agrégats d’alpha-synucléine et par une augmentation du stress oxydatif par un dysfonctionnement mitochondrial.
Anticorps VPS35
Parkin
La ligase ubiquitine E3 parkine (PRKN, locus autosomique récessif PARK2) coordonne les mécanismes de contrôle mitochondrial et module l'homéostasie lysosomale sous stress cellulaire. Il régule également les sites de contact mitochondries-lysosomes.
Les mutations de la PRKN sont la cause la plus fréquente d’apparition précoce de la maladie de Parkinson. On pense que la perte de l’activité E3 ligase de la parkine joue un rôle pathogène dans la MP héréditaire et sporadique.
Anticorps Parkin
Références Littéraires
- : "Mutations in LRRK2 cause autosomal-dominant parkinsonism with pleomorphic pathology." dans: Neuron, Vol. 44, Issue 4, pp. 601-7, (2004) (PubMed).
- : "A common LRRK2 mutation in idiopathic Parkinson's disease." dans: Lancet, Vol. 365, Issue 9457, pp. 415-6, (2005) (PubMed).
- : "Multicenter analysis of glucocerebrosidase mutations in Parkinson's disease." dans: The New England journal of medicine, Vol. 361, Issue 17, pp. 1651-61, (2009) (PubMed).
- : "Mutation in VPS35 associated with Parkinson's disease impairs WASH complex association and inhibits autophagy." dans: Nature communications, Vol. 5, pp. 3828, (2014) (PubMed).
- : "The role of Ca2+ signaling in Parkinson's disease." dans: Disease models & mechanisms, Vol. 10, Issue 5, pp. 519-535, (2018) (PubMed).
- : "A meta-analysis of genome-wide association studies identifies 17 new Parkinson's disease risk loci." dans: Nature genetics, Vol. 49, Issue 10, pp. 1511-1516, (2017) (PubMed).
- : "Parkinson's Disease: Biomarkers, Treatment, and Risk Factors." dans: Frontiers in neuroscience, Vol. 12, pp. 612, (2018) (PubMed).
- : "Dopamine: Functions, Signaling, and Association with Neurological Diseases." dans: Cellular and molecular neurobiology, Vol. 39, Issue 1, pp. 31-59, (2019) (PubMed).
- : "Emerging therapies in Parkinson disease - repurposed drugs and new approaches." dans: Nature reviews. Neurology, Vol. 15, Issue 4, pp. 204-223, (2020) (PubMed).
- : "The mechanistic role of alpha-synuclein in the nucleus: impaired nuclear function caused by familial Parkinson's disease SNCA mutations." dans: Human molecular genetics, Vol. 29, Issue 18, pp. 3107-3121, (2021) (PubMed).
- : "Mitochondria and Parkinson's Disease: Clinical, Molecular, and Translational Aspects." dans: Journal of Parkinson's disease, Vol. 11, Issue 1, pp. 45-60, (2021) (PubMed).
- : "Mitochondrial and Clearance Impairment in p.D620N VPS35 Patient-Derived Neurons." dans: Movement disorders : official journal of the Movement Disorder Society, Vol. 36, Issue 3, pp. 704-715, (2021) (PubMed).
- : "Influence of energy deficiency on the subcellular processes of Substantia Nigra Pars Compacta cell for understanding Parkinsonian neurodegeneration." dans: Scientific reports, Vol. 11, Issue 1, pp. 1754, (2021) (PubMed).
- : "Expanding the role of proteasome homeostasis in Parkinson's disease: beyond protein breakdown." dans: Cell death & disease, Vol. 12, Issue 2, pp. 154, (2021) (PubMed).
- : "Parkinson's Disease Genetics and Pathophysiology." dans: Annual review of neuroscience, Vol. 44, pp. 87-108, (2021) (PubMed).
- : "A Review of the Common Neurodegenerative Disorders: Current Therapeutic Approaches and the Potential Role of Nanotherapeutics." dans: International journal of molecular sciences, Vol. 23, Issue 3, (2022) (PubMed).
- : "Evidence That Substantia Nigra Pars Compacta Dopaminergic Neurons Are Selectively Vulnerable to Oxidative Stress Because They Are Highly Metabolically Active." dans: Frontiers in cellular neuroscience, Vol. 16, pp. 826193, (2022) (PubMed).
- : "GPNMB confers risk for Parkinson's disease through interaction with α-synuclein." dans: Science (New York, N.Y.), Vol. 377, Issue 6608, pp. eabk0637, (2022) (PubMed).
- : "Parkin regulates amino acid homeostasis at mitochondria-lysosome (M/L) contact sites in Parkinson's disease." dans: Science advances, Vol. 9, Issue 29, pp. eadh3347, (2023) (PubMed).

Goal-oriented, time line driven scientist, proficiently trained in different academic institutions in Germany, France and the USA. Experienced in the life sciences e-commerce environment with a focus on product development and customer relation management.
Go to author page



